Конспект урока по химии 8 класс "Генетическая связь между классами неорганических соединений"
Цель:
- сформировать понятие о генетической связи и генетическом ряде металла и неметалла;
- создать условия для выявления учащимися генетической связи между классами неорганических веществ;
- развивать представления о взаимопревращениях веществ разных классов.
Задачи:
- систематизировать знания учащихся о составе и свойствах основных классов неорганических веществ.
- развивать умения ставить проблемы, формулировать гипотезы и проводить их опытную проверку;
- совершенствовать умения работать с лабораторным оборудованием и реактивами.
Средства обучения: ПК, проектор, карточки, учебник, спиртовка, пробирки, подставка для пробирок, СuO, HCI, NaOH.
Ход урока
Мотивация к учебной деятельности
Материальный мир, в котором мы живем и крохотной частичкой, которого мы являемся, един и в то же время бесконечно разнообразен. Все в нем находится в непрерывном движении, в непрерывном химическом превращении. Бесконечно из одних веществ получаются другие.
Все в этом мире взаимосвязано и взаимообусловлено. Это всеобщий закон природы. Я предлагаю вам подтвердить или опровергнуть этот закон.
Задания
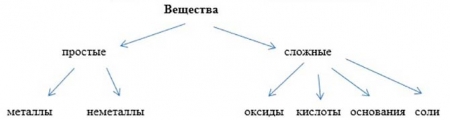
- Составьте схему классификации неорганических соединений, отвечая на вопросы
- Давайте вспомним, что такое вещество?
- На какие группы делят вещества по составу молекул?
- Дайте определение простым и сложным веществам.
- На какие группы делят простые вещества?
- На какие группы делят сложные вещества?
Классификация неорганических соединений
Далее каждая группа вытягивает карточку с заданием.
Задание по естественно-научной грамотности для 1 группы
Отгадай загадки
1. Лакмус будет в них краснеть, растворять магний, цинк, а иногда и медь,
А мелок в них посмотри, вмиг пускает пузыри!
И опасны для работы эти жгучие…
2. Определите, о каких четырех кислотах идет речь.
Жили – были 4 подружки – кислоты:
Первая была очень хитрая: ни запаха, ни цвета не имела,
Старалась не выделяться из толпы подружек, а сама в тоже время потихоньку поглощала влагу из воздуха и других газов.
Характер был у нее жгучий. Кожу, ткани и древесину она при встрече тут же обугливала, а при встрече с водой начинала кипеть и брызгаться.
Опасная была кислота…
Вторая подружка – имела такой же резкий характер, как и запах.
С водой общаться любила, но при этом выделяла молекулы газа, которые притягивали водяные пары, поэтому она начинала "дымиться" во время общения…
Третья и четвертая кислоты были лучшими подружками, они разлагались на воду и оксид – это их сближало… и …
3. Скучно было жить подружкам. и решили они найти друзей.
Кинули кличь. Все, кто откликнулся, они вносили в список, и образовалось целое государство…, которое объединяло то, что…
Задание для 2 группы
Ежегодно выбрасывается в атмосферу вследствие хозяйственной деятельности человека, включая сжигание ископаемого топлива. Лишь 57-60% этого газа, остается в атмосфере. Некоторая часть растворяется в океанах, а некоторая поглощается растениями в процессе роста.
Участвует во многих метаболических процессах. Он регулирует работу дыхательного и сосудисто-двигательного центра, возбудимость нервной системы, тонус сосудов, бронхов, поддерживает обмен веществ. Негативно влияет на организм человека и является канцерогеном.
Нахождение в помещении с высокой концентрацией этот газ может вызывать слабость, сонливость, головные боли, проблемы с концентрацией внимания, и даже негативные изменения в крови.
- Как называется оксид (газ), необходимый для фотосинтеза? Дайте два названия этому веществу.
- К какой группе оксидов относится данный оксид?
- Растворяется ли данный оксид в воде?
- Какая кислота соответствует данному оксиду?
Задание для 3 группы
Зимой обледеневшие дороги и тротуары посыпают солью, чтобы избавиться от гололеда и обеспечить безопасное движение пешеходов и различного транспорта. Поваренная соль, вступая в реакцию с замерзшей водой, повышает ее соленость, а соленая вода не замерзает при температуре ниже – 15 градусов. Проезжая часть быстро очищается от льда и снега, повышается безопасность движения.
Многим известен способ лечения насморка или радикулита с помощью поваренной соли. Ее нагревают на сковороде или в духовке, насыпают в мешочек из плотной ткани и прикладывают к больному месту на несколько часов.
- Объясните, почему при -30 градусах нецелесообразно обрабатывать дороги солью?
- Какие свойства поваренной соли используются в этом рецепте?
- Приведите другое название поваренной соли?
- К какому классу соединений относится данное вещество?
Задание для 4 группа
В далекие времена люди считали, что всемогущие сверхъестественные силы могут сделать все. Священнослужители, для убеждения верующих в чудеса, проделывали следующее: медленно, торжественно, с молитвами наливали "чистую" воду в сосуд, где она немедленно приобретает малиновый цвет. Затем эту жидкость выливают в другой прозрачный сосуд, происходит обесцвечивание раствора.
Для приготовления штукатурного раствора рекомендуют использовать только свежегашеную известь. Гашение извести протекает по уравнению: СаО+Н2О = Са(ОН)2
- Какое вещество находилось первоначально в сосуде? Объясните наблюдаемое явление.
- Телята могут слизывать побелку со стен и перегородок телятника. Недостаток какого вещества в их рационе можно предположить?
- К какому классу соединений относится данное вещество?
Актуализация знаний
4 группы, по 4-5 человек; карточки с формулой вещества у каждой группы.
Задание
Распределите вещества по классам соединений. Назовите вещество.
У каждой группы есть свое название: оксиды, кислоты, основания, соли. Прикрепить свое вещество в таблицу и назвать его: CuCI2; Cl2; Na2O ; H2SO3; Cu(OH)2; CuO; HCl; SO2; Ca(OH)2; S; Na2SO3; Cu; Na; ZnCl2; Ba(OH)2; K2O; H3PO4; HNO2; KHCO3; NaOH.
|
металлы |
неметаллы |
оксиды |
кислоты |
основания |
соли |
|
|
|
|
|
|
|
Проверка (Слайд презентации)
Работа в группах
Исключите лишнее вещество из группы сложных соединений. Обоснуйте свой ответ.
|
металлы |
неметаллы |
оксиды |
кислоты |
основания |
соли |
|
Cu Na |
Cl2 S |
Na2O CuO SO2 K2O |
H2SO3 HCl H3PO4 HNO2 |
Сu(OH)2 Ba(OH)2 NaOH Ca(OH)2 |
CuCI2 Na2SO3 ZnCl2 KHCO3 |
Задание
Составьте схему превращений веществ по сказке по сказке.
Сказка
В некотором царстве, в некотором государстве было 2 больших княжества, которые отличались друг от друга. Одно было населено очень твердыми гражданами, которые обладали металлическим блеском, серым цветом, проводили электрический ток. Только одна ртуть составляла исключение, она была жидкостью.
Второе княжество было разно национальным. Его населяли газы, жидкость, твердые вещества разного цвета, не проводящие электрический ток. Исключением является углерод. И то, и другое княжество жили в атмосфере кислорода. Кислород был настолько силен, что окислял их в оксиды.
Периодически проходили дожди. И в сезоны дождей оксиды растворялись. Но, даже в этом случае, княжества отличались друг от друга. В первом княжестве текли щелочные реки, которые покрыты нерастворимыми берегами. Во втором княжестве - реки представлены чистейшими кислотами, а берега состояли из нерастворимых кислот.
Однажды появился могучий человек, лаборант по профессии. И решил сдружить княжества. Объединил металлы и неметаллы, основные и кислотные оксиды. Объединил реки в обще русло – единое государство, под названием соли. (Проверка составленной схемы у доски)
Первичное закрепление во внешней речи
Вернемся к нашей таблице. Составьте из различных веществ генетические ряды. (затруднение)
Проводим аналогию с понятием "ген", родство в биологии.
Ребята, давайте поработаем с учебником. Выясним, что такое генетический ряд веществ?
Генетический ряд - это ряд веществ, разных классов соединений, содержащих в своем составе один и тот химический элемент
Вернемся к нашей таблице. Составьте из различных веществ генетические ряды.
Проверка
Cu → CuО → CuCI2 → Cu(OH)2
S → SO2 → H2SO3
Cl2 → HCl → ZnCl2
Na → Na2O → NaOH → Na2SO3
Включение в систему знаний
В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Ребята, согласны ли вы с всеобщим законом природы?
Давайте докажем его опытным путем. Но, прежде давайте вспомним ПТБ.
Самостоятельная работа с самопроверкой по эталону
Осуществите превращения веществ, напишите уравнения реакций.
Сu → СиО → СиСI2 → Сu(ОН)2
Сдаем тетради и проверяем по эталону.
Рефлексия деятельности, д/з.