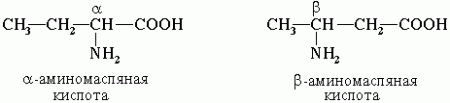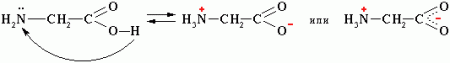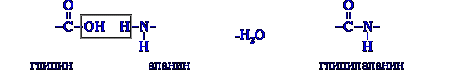Конспект урока химии 8 класс "Аминокислоты: строение, химические свойства, применение и получение"
Цели урока:
- Дать понятие об аминокислотах как органических амфотерных соединениях.
- Рассмотреть их строение, классификацию, изомерию и номенклатуру.
- Разобрать основные способы получения аминокислот.
Задачи:
- знание строения, классификации, видов изомерии аминокислот и основы их номенклатуры;
- основных способов получения аминокислот и их применение. умение проводить сравнение свойств аминов и карбоновых кислот, записывать необходимые уравнения реакций
- умение работать с текстом учебника и устанавливать межпредметные связи (с биологией), навыки самообразования и самооценки;
- наличие любознательности, формирование интереса через изучение некоторых моментов роли аминокислот для жизнедеятельности человека.
Ход урока
Учеными выявлено, что в некоторых живых организмах есть два сильных яда: сакситоксин, батрахотоксин. Что это за вещества и где они содержаться, попробуйте ответить, прочитав текст.
Яд сакситоксин содержит южноамериканская лягушка - пятнистый древолаз или кокой. Ее яд годами остается активным и не имеет противоядия. Попадая в царапины и порезы кожи человека в количестве 0,001 мг, он приводит к смертельному исходу из-за нервно-мышечного паралича сердца. Пожалуй, эта лягушка самое ядовитое животное на Земле.
Даже яд кураре в 30 раз менее активен (яд гремучей змеи). Один из сильнейших растительных ядов - аконитин содержится в ядовитых лютиках и других растениях. Смертельная доза для человека 2,5 мг.
Анчар о котором писал Пушкин - тропическое южноазиатское дерево из семейства тутовых, выделяющее ядовитый млечный сок. В красном мухоморе находится яд - мускарин.
Бледная поганка содержит два яда: аманитоксин, вирозин.
Яды являются кольцевыми пептидами, т.е. состоят из аминокислот и выдерживают нагревание до 200 оС. Отравление бледной поганкой приводит к смерти. Удивительно, что вместе с этим бледная поганка является "складом" многих витаминов и полезных аминокислот: триптофана, глутаминовой кислоты, аргинина, лизина.
Так вот сегодня мы узнаем об этих интересных органических веществах. С одной стороны являющимися кирпичиками жизни, а с другой сильными ядами. В 1820 г. французский химик Анри Браконно проводил опыты с веществами животного происхождения. В результате длительного нагревания кожи, хрящей и сухожилий с раствором серной кислоты он получил некоторое количество белых кристаллов сладкого вкуса.
Это вещество получило название гликокол, оно долгое время считалось "родственником" углеводов, пока в 1838 г. голландский химик Г. Мульдер не обнаружил в его составе азот. Спустя еще 6 лет Э. Хорсфорд установил формулу вещества C2H5O2N. (Глицерин)
Наш организм - очень сложная система, которая работает даже в состоянии покоя. Для нормальной жизнедеятельности человека необходима 21 аминокислота. Организм способен самостоятельно синтезировать12 кислот, а 9-не синтезируется.
Аминокислоты, которые не синтезируются можно получить только с продуктами питания. Только при этом питание должно быть правильным.
Общую формула аминокислот:
NH2 – CH – COOH
|
R
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Например:
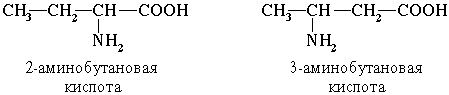
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Пример:
Для α-аминокислот R-CH(NH2)COOH, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Физические свойства аминокислот
Бесцветные кристаллические вещества с температурами плавления 150 - 250 oС, хорошо растворимы в воде (лучше, чем в органических растворителях), многие - сладкие.
Все они содержат аминогруппу (-NH2), имеющую щелочные свойства, и карбоксильную группу (-COOH), имеющую кислотные свойства.
Основные аминокислоты содержат более одной аминогруппы, а кислые – больше одной карбоксильной группы. Аминокислоты соединяются в молекуле белка с помощью пептидной связи, которая возникает между карбоксильной группой одной аминокислоты и аминогруппой другой с выделением молекулы воды.
При соединении большого количества аминокислот образуется полипептид. Белковая молекула может состоять из одной или нескольких полипептидных цепей. Благодаря наличию радикалов аминокислоты могут вступать в разнообразные химические реакции, в том числе и после того, как они войдут в состав белковой молекулы. В связи с этим белкам присуща высокая реакционная способность.
Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттерион.
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе: цвиттерион.
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
Видео опыт "Свойства аминоуксусной кислоты"
2. Поликонденсация → образуются полипептиды (белки):
При взаимодействии двух α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерифика-ции): NH2-CH2-COOH + CH3OH HCl (газ)→ NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир 2-аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
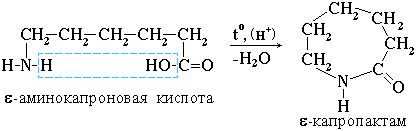
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
Свойства аминогруппы (основность)
1. С сильными кислотами → соли: HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно первичным аминам): NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O гидроксокислота
Качественная реакция
1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
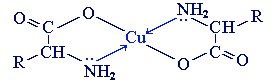
2. С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
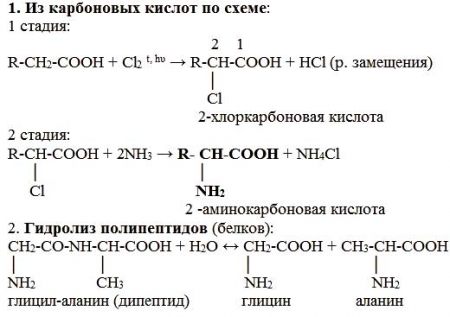
Получение:
3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α-аминокислоты белков.
Применение аминокислот
- аминокислоты широко распространены в природе;
- молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки; аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи;
- аминокислоты прописываются при сильном истощении, после тяжелых операций;
- их используют для питания больных;
- аминокислоты необходимы в качестве лечебного средства при некоторых болезнях (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка);
- некоторые аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост;
- имеют техническое значение: аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна – капрон и энант.
Домашнее задание:
1. Изучить теоретический материал по данной теме;
2. Выполните следующие задания:
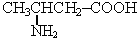
- Назовите вещество (см. рис.)
- Составьте формулу 3 – аминопропановой кислоты
- 3. Как называется способность вещества проявлять кислотные и основные свойства?