Конспект урока химии 8 класс "Воздух, его состав. Оксиген"
Тема урока: Воздух, его состав. Оксиген. Распространенность оксигена в природе. Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойстваю.
Цель урока: знакомство с кислородом, как с химическим элементом.
Задачи:
- изучить состав воздуха;
- ознакомить учащихся с работами Лавуазье об установлении состава воздуха;
- сформировать представление о воздухе как смеси газов.
Оборудование: периодическая система химических элементов Д.И. Менделеева, презентация, материалы для опытов, раздаточный материал.
Ход урока
Орг. момент
Приветствие учащихся. Проверка готовности к уроку.
Актуализация знаний
Закончи предложение:
- Простые вещества – это… (вещества, образованные атомами одного химического элемента. Некоторые простые вещества состоят из молекул)
- Сложные вещества - это… (вещества, в состав которых входят атомы различных химических элементов)
- Смесь - это… (неупорядоченная совокупность, в состав которой входят различные составляющие (элементы). Система, состоящая из газовых, жидких или твердых компонентов (составляющих), между молекулярными частицами которых отсутствуют химические связи.
Беседа
- Чем отличаются смеси от чистых веществ? (Чистые вещества состоят из частиц одного вида, а смеси - из частиц разного вида)
- Как можно разделить смесь на отдельные вещества? (фильтрованием, отстаиванием, выпариванием)
- Что означают следующие записи (написаны на доске). Подчеркните формулы сложных веществ.
4N2 3H2O 4S P2O5 2Fe 3CuO 4O3 3NH3
Объяснение нового материала
Состав воздуха показан в таблице.
|
Составные части воздуха |
||
|
Постоянные |
Переменные |
Примеси |
|
Кислород О2 |
Углекислый газ СО2 |
Оксиды серы |
Кислорода в воздухе содержится 78,08%, азота – 20, 95%, инертных газов – 0,93%, углекислого газа – 0,03%, озона – 0,00004%. (Содержание составных частей воздуха указано по объему)
История открытия состава воздуха
(Показ презентации, рассказ учителя)
Английский химик Джозефе Пристли в результате опыта в 1774 году открыл кислород. Он обнаружил, что после сгорания горючих веществ объем взятого для опытов воздуха уменьшается на 1/5 и воздух становится не пригодным для горения и дыхания.
Пристли заметил, что воздух, не пригодный для дыхания, снова приобретает обычные свойства, если поместить в него на какое-то время растение, разложив оксид Меркурия в герметично закрытом сосуде. (направил солнечные лучи на это соединение с помощью мощной линзы): t0C
2HgО → 2Hg + O2↑
Видео показ опыта
Защита атмосферы от загрязнения
(рассказ учителя с элементами беседы)
- создание безотходных технологических процессов;
- вынос крупных мощных предприятий за пределы городов;
- создание загородных кольцевых путей для транспорта;
- перевод городского транспорта на электротранспорт;
- установка на заводских и фабричных трубах пыле газоуловителей;
- озеленение городов и сел.
- Сегодня на уроке мы рассмотрим "Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства".
- Со словом кислород вы знакомы уже давно. Но вы не знаете, как его можно получить, какое место занимает кислород в природе. Это сегодня мы с вами подробно изучим.
- Рассмотрим физические и химические свойства кислорода.
Физические свойства
Кислород – бесцветный газ. Без вкуса, без запаха, относительно малорастворим в воде (в 100 объемах воды при t=200C растворяется 3,1 объема кислорода). Кислород немного тяжелее воздуха: 1 л кислорода при н.у. весит 1,43 г, а 1 л воздуха – 1,29 г (н.у.: t = 20 0C, P = 760 мм рт. ст. или 1 атм = 0,1 МПа). При давлении 760 мм. рт. ст. и температуре -183 0С (Температура кипения) кислород сжижается, а при снижении температуры до -218,8 0С затвердевает.
Химические свойства
Как элемент, занимающий место в правом верхнем углу периодической системы химических элементов Д. И. Менделеева, кислород обладает ярко выраженными неметаллическими свойствами. Имея на наружном энергетическом уровне 6 электронов, атом кислорода может перейти к предельно заполненной 8-й электронной оболочке (условие максимальной химической устойчивости), присоединив 2 электрона. Поэтому в реакциях с другими элементами (кроме фтора) кислород проявляет исключительно окислительные свойства.
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно, кроме галогенов, золота и платины.
Такой активный металл, как цезий, самовозгорается в кислороде воздуха уже при комнатной температуре.
- Давайте охарактеризуем простое вещество - кислород. Для этого я вам раздам листочки с таблицей. Ее надо заполнить.
|
Химический символ кислорода |
Порядковый номер |
Относительная атомная масса (О) |
Относительная молекулярная масса |
Валентность кислорода |
|
|
|
|
|
|
- Итак, с заданием справились. С общими понятиями познакомились. Идем далее. Сейчас я вам зачитаю историю открытия кислорода.
- Вы должны записать в тетрадь фамилии ученых, которые имеют отношение к истории открытия кислорода.
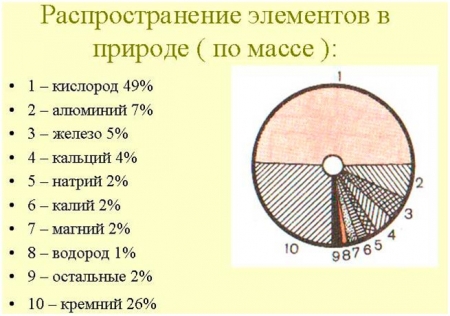
- Из схемы видно, что на долю кислорода приходится 49% по массе от других элементов, приведенных в таблице. Стоит отметить, что это не маленький процент.
- Кислород – самый распространенный химический элемент в земной коре. Кислород входит в состав почти всех окружающих нас веществ.
- Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород. Кислород является также важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека. Переходим к способам получения кислорода.
Получение в лаборатории
- В лаборатории кислород получают при разложении некоторых сложных кислородсодержащих веществ:
1) 2H2O→2H2 + O2
MnO2
2) 2H2O2 → 2H2O + O2
t
3) 2HgO → 2Hg + O2
t, MnO2
4) 2KClO3 → 2KCI + 3O2
t
5) 2KMnO4 → K2MnO4 + MnO2 + O2
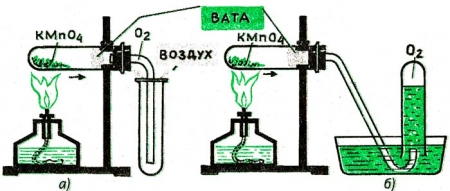
- Это способы получения кислорода, теперь давайте рассмотрим прибор, с помощью которого мы можем получить кислород в лаборатории. (Учитель объясняет прибор, при помощи которого можно получить кислород из перманганата калия. Схема прибора дана в книге)
Собирание кислорода методом вытеснения воздуха (а);
методом вытеснения воды (б).
Физминутка
Учитель предлагает обучающимся несколько упражнений. (поворот головы влево и вправо, движение глазами на счет 1-4 вверх, вниз, влево, вправо, вдаль)
Лабораторная работа "Получение кислорода разложением пероксида водорода"
(Инструктивная карточка к лабораторной работе на слайде)
Цель: получить кислород разложением пероксида водорода; доказать наличие кислорода.
Ход работы
- Получение кислорода разложением пероксида водорода. В пробирку с пероксидом водорода добавьте катализатор – оксид марганца IV.
- Доказательство наличия кислорода. В пробирку с выделавшимся в результате реакции кислородом поместите тлеющую лучину/ (для этого лучину подожгите в пламени спиртовки, а затем погасите ее)
Что наблюдается в результате реакции?
Какие выводы можно сделать?
Планируемый ответ
- В результате лабораторной работы при разложении пероксида водорода наблюдали выделение кислорода.
2Н2О2 =2Н2О + О2↑. - Доказали наличие кислорода по возгоранию тлеющей лучины.
Уравнения реакций получения кислорода в лаборатории учащиеся записывают в тетрадь.
Получение в промышленности
В промышленности кислород получают из воздуха, который представляет собой смесь различных газов, основные компоненты в нем – азот и кислород. Для получения кислорода воздух под давлением сжимают. Так как температура кипения жидкого азота (-196 0С) ниже температуры кипения жидкого кислорода(-183 0С), то азот испаряется, а жидкий кислород остается. Газообразный кислород хранят в стальных баллонах под давлением 15 МПа.
Роль кислорода в природе и его применение в технике
При участии кислорода совершается один из важнейших жизненных процессов – дыхание. Окисление кислородом углеводов, жиров и белков служит источником энергии живых организмов. В организме при участии кислорода совершается один из важнейших жизненных процессов – дыхание.
Окисление кислородом углеводов, жиров и белков служит источником энергии живых организмов. В организме человека содержание кислорода составляет 61% от массы тела. В виде различных соединений он входит состав всех органов, тканей, биологических жидкостей. Человек вдыхает в сутки 20-30 м3 воздуха.
Кислород широко используют практически во всех отраслях химической промышленности: для получения азотной и серной кислот, в органическом синтезе, в процессах обжига руд и др. Процесс производства стали невозможен без кислорода, металлургия использует свыше 60% всего промышленного кислорода.
Горение водорода в кислороде сопровождается выделением значительной энергии – почти 286 кДж/моль. Температура пламени достигает 3000 °С. Жидкий кислород применяют для изготовления взрывчатых смесей.
Огромная потребность в кислороде ставит перед человечеством серьезную экологическую проблему сохранения его запасов в атмосфере. До настоящего времени единственным источником, пополняющим атмосферу кислородом, является жизнедеятельность зеленых растений. Поэтому особо важно следить за тем, чтобы их количество на Земле не уменьшалось.
Закрепление изученного
- Решите экологическую проблему "Осуществимы ли жизненные процессы на Земле без кислорода?"
Планируемый ответ
- Кислород – основной биогенный элемент, входящий в состав молекул всех важнейших веществ, обеспечивающих структуру и функции клеток – белков, нуклеиновых кислот, углеводов, липидов, а также множества низкомолекулярных соединений.
- В результате процесса фотосинтеза масса кислорода в воздухе пополняется.
- Кислород является окислителем многих химических веществ как в живой, так и в неживой природе.
Вывод: жизнь на Земле без кислорода невозможна.
Работа в командах
Команда 1 "Оксиген"
Вставьте пропущенные слова так, чтобы выражение стало завершенным.
- Вещества делятся на ... и ... .
- Ядро атома оксигена содержит 8 ... и 8 ... .
Поставьте знак "+", если утверждение правильное, и знак "-", если ложное.
- кислород - типичный металл.
- относительная молекулярная масса кислорода – 16.
- химическая формула кислорода - О7.
- без кислорода невозможна жизнь растений.
Завершите предложение, вставив слова "кислород", "оксиген".
- самый большой контент ... в горных породах и минералах.
- в воде растворен ...
- в аквариуме рыбы дышат ..., растворенным в воде.
- в состав молекулы воды ходит ... .
Команда 2 "Кислород"
Вставьте пропущенные слова так, чтобы выражение стало завершенным.
- кислород - простое вещество, образованное элементом ... .
- оксиген образует простые вещества: ..., ... .
Поставьте знак "+", если утверждение правильное, и знак "-", если ложное.
- кислород - это твердое вещество.
- относительная молекулярная масса кислорода – 22.
- химическая формула кислорода О2.
- без кислорода невозможна жизнь человека - ...
Дополните предложение, вставив слова "Оксиген", "кислород", "Озон".
- Самый большой контент ... в атмофере в озоновом слое.
- Вода состоит из двух атомов водорода и одного атома ...
- Оксиген образует простые вещества: ..., ... .
Домашнее задание
- Проработать § 21, конспект.
- Написать реферат "Загрязнители воздуха".
Рефлексия
Блиц-опрос:
- Всегда двухвалентный. (оксиген)
- Газ без цвета, запаха, вкуса. (кислород)
- Входит в состав воды. (оксиген)
- В воде содержится растворенный... (кислород)
- Мы им дышим. (кислород)
- Озон состоит из трех атомов. (оксигена)
- Растения выдыхают. (кислород)
- Запишите по 1-2 слову на листочке, что нового вы узнали на уроке и повесьте их на дереве "Знаний".
- 32 16 8. Какое отношение эти числа имеют к кислороду?