Интегрированное занятие по математике и химии "Определение концентрации раствора"
Цель занятия: систематизация учебного материала по теме "Определение концентрации раствора".
Задачи:
- закрепить знания, полученные учащимися на уроках органической химии и математике;
- обогатить интеллект и кругозор дополнительными знаниями;
- воспитание любви и уважения к изучаемым дисциплинам.
Планируемые результаты обучения:
- умение разбавлять и концентрировать исходный раствор простейшими способами;
- умение делать осознанный выбор способа и метода решения задач на уроке химии;
- умение доказывать с помощью математических расчетов выводы, сделанные на основе эксперимента.
Ход интегрированного занятия
Организационный этап
Для занятия формируются 2 команды из обучающихся 2 курса. Заранее командам дается задание – придумать название команде, выбрать капитана и придумать приветствие соперникам и жюри.
Представление участников
Преподаватель химии:
Без химии жизни, поверьте, нет,
Без химии стал бы тусклым весь свет.
С химией ездим, живем и летаем,
В разных точках Земли обитаем,
Чистим, стираем, пятна выводим.
Химией лечимся, клеим и шьем
С химией мы бок о бок живем!
Так что вы без нее пропадете,
Если значенье ее не поймете!
А чтобы больше и лучше все знать,
Надо химию понять!
Химия – наука удивительная. Она конкретная и касается бесчисленных полезных и вредных веществ вокруг нас и внутри нас
Поэтому химия нужна и строителю, и фермеру, и программисту, и домохозяйке. Она абстрактная и имеет дело с мельчайшими частицами, которые не разглядишь в микроскоп, со сложными формулами и на первый взгляд непонятными законами.
Если считать первыми химиками древнеегипетских жрецов, то химия – наука-старушка, ей несколько тысяч лет. Тем не менее, в ней до сих пор так много неясного и неоткрытого! Химия – наука серьезная, изучать ее нелегко. Но сегодня, отвечая на вопросы, вы убедитесь, что химия не так трудна и недоступна, как казалось раньше.
Преподаватель математики: Математика многообразна и многогранна. Существует ряд ситуаций в образовательном процессе, когда при изучении какой-либо темы по физике, химии, биологии и т.д. затрагиваются понятия математики, например, существуют задачи, которые решают как на уроках математики, так и на уроках химии, их называют прикладными задачами.
Прикладная (практическая) задача – это задача, поставленная вне математики и решаемая математическими средствами. Способы решения задач представляют и учителя химии, и математики, но есть проблема: математики знают математику, а химики - химию. И не всегда способы совпадают.
Эпиграф занятия: "Решение задач - практическое искусство, подобное игре на фортепьяно, научиться ему можно только постоянно решая задачи и рассматривая решения трудных задач в качестве образцов". (Д. Пойа)
Преподаватель химии: Наше занятие пройдет в форме игры, для чего были сформированы 2 команды из обучающихся групп... Разрешите мне представить жюри, которое будет внимательно следить за мероприятием. (представление жюри)
Преподаватель математики: Теперь давайте познакомимся с командами. Вам было дано домашнее задание – придумать название своей команде, выбрать капитана и придумать приветствие соперникам и жюри. За представление команды жури выставляют баллы от 0 до 5.
Команда "Химики"
Девиз: Нам не преставляет муки грызть гранит химической науки.
Обращение к соперникам: Да, соперники сильны, но для нас вы не страшны. Мы "химичим" с малых лет, в этом наш большой секрет!
Обращение к жюри: Вам судить будет не сложно, ошибаться невозможно: лучше нас, поверьте нет! Это знает целый свет!
Команда "Математики"
Девиз: Если много хочешь достичь и узнать, надо твердо на пять математику знать!
Обращение к соперникам: Попотеть придется вам! Мы для вас не по зубам
Обращение к жюри: Спорить мы не будем с вами: место первое за нами!
Мотивация занятия
Преподаватель химии: Открываем тетради и записываем тему занятия "Определение концентрации раствора".
Ребята, как вы думаете, чему мы должны научиться на занятии? (Познакомить с приемами решения задач в математике и химии, расширить знания о значении этих растворов в быту, сформировать целостную картину о взаимосвязи учебных дисциплин в техникуме)
И так продолжим работу. Согласно эмблемам, просьба занять места в группах.
Разминка
Команды получают листы бумаги, на которых написано слово: сульфадиметоксин. (применяется при лечении пневмонии)
Необходимо, используя буквы этого слова, составить как можно больше слов, имеющих непосредственную связь с химией за 3 минуты. За каждое слово команды получают 1 балл.
Конкурс шифровальщиков
Здесь зашифрованы слова М.В. Ломоносова. Чтобы расшифровать запись, нужно найти этот элемент в таблице Менделеева, в названии элемента выбрать ту букву, которая указана цифрой - индексом. Если индекса нет, то надо читать первую букву химического знака.
Es4Li2RbSnKN3 HgAtSPtB3Co2AgTeTi2Mn3AlBe2Na3 ClO2MoZn2As5
Br2Ru2OMg5 SHF3Zr2 V DbCu2C3S4 … (Широко распростирает химия руки свои в дела ...)
Практическое задание № 1
Расположите пробирки с раствором по убыванию интенсивности окраски. За правильно составленный ряд команда получает 3 балла.
Жюри и болельщики просматривают ролик.
Анаграммы
Преобразуйте анаграммы и получите химические термины.
За каждое верное слово команда получает 1 балл.
Теоретические вопросы по учебным дисциплинам
Вопросы обучающимся для проверки их знаний перед проведение 2 и 3 практических заданий.
Преподаватель химии: Сегодня на уроке мы рассмотрим решения химических задач, для чего нужно вспомнить решение линейных уравнений, систем уравнений, пропорций. Мы с вами увидим, как математические методы решения задач помогают при решении задач по аналитической химии. Поэтому занятие мы проведем вместе с преподавателем математики.
Но вначале давайте вспомним некоторые химические понятия.
1. Что такое раствор?
2. Массовой долей растворенного вещества называют…?
3. Из чего складывается масса раствора?
Преподаватель математики:
4. Дать определение процента.
5. Как найти процент от числа?
6. Как найти число по его проценту?
7. Как найти, сколько процентов составляет одно число от другого?
Предполагаемые ответы учащихся:
- Раствор – однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
- Массовой долей растворенного вещества называют отношение массы растворенного вещества к общей массе раствора.
- Масса раствора складывается из массы растворителя и массы растворенного вещества.
- Процентом называется сотая часть величины.
- Чтобы найти процент от числа, надо величину поделить на сто и умножить на число процентов.
- Чтобы найти число по его проценту, надо величину разделить на число процентов и умножить на сто. Чтобы найти, сколько процентов одно число составляет от другого, надо первое число разделить на второе и умножить на сто.
За каждый верный ответ – 1 балл.
Преподаватель химии: Очень часто в лабораторной практике и при решении олимпиадных задач приходится встречаться со случаями приготовления растворов с определенной массовой долей растворенного вещества, смешением двух растворов разной концентрации или разбавлением крепкого раствора водой.
В некоторых случаях можно провести достаточно сложный арифметический расчет. Однако это малопродуктивно. Чаще для этого лучше применить правило смешения. (диагональную модель "конверта Пирсона", или, что то же самое, правило креста)
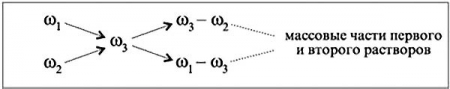
Допустим, нужно приготовить раствор определенной концентрации, имея в распоряжении два раствора с более высокой и менее высокой концентрацией, чем нужно нам. Тогда, если обозначить массу первого раствора через m1, а второго – через m2, то при смешивании общая масса смеси будет: m1 + m2.
Пусть массовая доля растворенного вещества в первом растворе – ω1, во втором – ω2, а в их смеси – ω3. Тогда общая масса растворенного вещества в смеси будет слагаться из масс растворенного вещества в исходных растворах: ω = ω1m1 + ω2m2 / m1 + m2
Преподаватель математики: При решении задач на растворы с разными концентрациями чаще всего применяют диагональную схему правила смешении. При расчетах записывают одну над другой массовые доли растворенного вещества в исходных растворах, справа между ними – его массовую долю в растворе, который нужно приготовить, и вычитают по диагонали из большего меньшее значение.
Разности их вычитаний показывают массовые доли для первого и второго растворов, необходимые для приготовления нужного раствора.
Практическое задание № 2. Определение процентной концентрации раствора соли
15 граммов поваренной соли (NaCl) растворите в воде. Определите процентную концентрацию полученного раствора. (решить задачу 2 способами – с помощью формулы и одним из нестандартных способов) (0,06 или 6%)
За правильно оформленную и решенную 2-мя способами задачу команда получает по 5 баллов.
Игра с жюри и болельщиками
Шуточные вопросы – загадки:
- Какой элемент не имеет постоянной прописки в периодической системе? (Водород)
- Какой элемент всегда рад? (Радон)
- Какой неметалл является лесом? (Бор)
- Какие химические элементы утверждают, что могут другие вещества "рождать"? (углерод, водород, кислород)
- В состав названий каких элементов входит напиток морских пиратов? (бром, хром)
- От какого металла нужно убрать две буквы, чтобы получилась известная кость скелета животного или человека? (Серебро)
- Название какого металла несет в себе волшебника? (Магний)
- Какие простые вещества при обычных условиях находятся в жидком состоянии? (Бром, ртуть)
- Как обуглить дерево без огня? (Серной кислотой)
- Как получить воду из огня? (При горении водорода)
- Как очистить яйцо, не разбивая скорлупы? (Опустить в раствор кислоты)
Ребусы
Расшифруйте ребусы и получите химические или математические термины.
За каждый верно разгаданный ребус команда получает 1 балл.
Практическое задание № 3. Определение процентной серной кислоты
Дана емкость с серной кислотой и таблица плотностей растворов. Определение процентной серной кислоты. (решить задачу 2 способами – с помощью формулы и одним из нестандартных способов). (ρ = 1,303; v = 40%)
За правильно оформленную и решенную 2-мя способами задачу команда получает по 5 баллов.
Игра с жюри и болельщиками
Шуточные загадки
Пусть математик удивится:
Один прибавив к одному,
У химика равно один. (Реакция соединения)
Скажите, что это такое:
Один нырнул, а всплыло – двое. (Реакция разложения)
Получишь газы из воды,
Смешаешь вместе – жди беды. (Смесь из воды и кислорода)
Адрес точный, если спросят: 32,16,8. (Кислород)
Металл в солях – опора многих,
А нас без них, не носят ноги. (Калий)
Далее в зависимости от времени проводится последний конкурс интегрированного занятия – игры "А знаешь ли ты теорию?"
Команды по очереди выбирают вопрос, называя тему и цену вопроса в баллах. Право на ответ имеет команда, выбравшая вопрос. При правильном ответе команда получает фишку с выигранным числом баллов, при неправильном – право ответа передается команде, капитан которой первым поднимет руку. Если выпадает "Кот в мешке", команда передает вопрос одному из соперников по своему выбору.
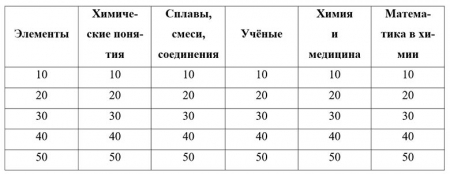
Элементы
10. Какой элемент носит имя героя древнегреческой мифологии? (Титан)
20. Этот элемент входит в состав белка – основы всего живого на Земле. А название его переводится как "Безжизненный". (Азот)
30. Какой элемент считают царем живой природы? (Углерод)
40. Какой металл плавится от тепла человеческой руки? (Цезий)
50. Что общего между яичной скорлупой, раковиной моллюска, жемчужиной и мелом? (Все они содержат кальций)
Химические понятия
10. Что такое "сухой лед"? (Твердый углекислый газ)
20. Какой газ называют "веселящим" и почему? (Оксид азота (I), так как он оказывает опьяняющее действие на организм человека)
30. Явление, для описания которого поэт Вадим Шефнер употребил метафору: "рыжая крыса грызет металлический лом" (Коррозия металлов)
40. Что такое "царская водка" и почему ее так называют? (Смесь 1 части азотной кислоты и 3 частей соляной кислоты. Растворяет "царя металлов" - золото)
50. Кот в мешке. Чем объяснить появление мерцающих огоньков на кладбище в ночное время? (Окислением фосфина, который образуется при разложении костей)
Сплавы, смеси, соединения
10. Жидкая смесь природных углеводородов. (Нефть)
20. Какую кислоту можно найти в минеральной воде и лимонаде? (Угольную)
30. Жидкость, снижающая температуру замерзания воды. (Антифриз)
40. Кот в мешке. Сплав, из которого сделаны и Медный всадник, и Царь-колокол, и Царь-пушка. (Бронза)
50. Какое молоко не пьют? (Известковое молоко Са(ОН)2)
Ученые
10. Известно, что один ученый наблюдал солнечное затмение, поднявшись на воздушном шаре выше облаков. А приземлиться ему пришлось в другой губернии, далеко в поле. Из ближайших деревень сбежались люди и посчитали, что это спустился на землю Бог. О каком ученом идет речь? (о Д.И. Менделееве)
20. Какой русский химик известен и как композитор? (Александр Порфирьевич Бородин)
30. Кому принадлежат слова: "Широко распростирает химия руки свои в дела человеческие"? (Ломоносову)
40. Кот в мешке. Какое хобби было у Менделеева? (Изготовление чемоданов)
50. Назовите причину, по которой результаты опытов Роберта Бойля и М.В. Ломоносова по прокаливанию ртути в реторте были разными: в опыте Бойля масса продуктов реакции превысила массу исходных веществ, а в опыте Ломоносова - осталась неизменной. (Р. Бойль проводил опыт в открытой, а М. Ломоносов – в запаянной реторте)
Химия и медицина
10. Какие вещества используют для обеззараживания ран? (Спирт, спиртовой раствор йода, растворы перманганата калия, пероксида водорода)
20. Какая кислота содержится в желудке здорового человека? (Соляная)
30. Ионы какого металла обладают бактерицидными свойствами? (Серебра)
40. Недостаток этого элемента вызывает заболевание щитовидной железы. (Йод)
50. Какой металл называют металлом хирургов? (Тантал)
Математика в химии
10. Первая попытка по математизации химии была сделана ... Он намеревался написать подобный химический трактат, в котором он хотел изложить все существующее на тот момент химическое знание в аксиоматической манере. (В.М. Ломоносов)
20. Как-то раз Гаусс спорил с Авогадро (1776-1856) о сущности научных законов. Гаусс утверждал, что законы существуют только в математике, а потому химия почитаться за науку не может.
В ответ Авогадро сжег 2 л водорода в литре кислорода и, получив два литра водяного пара, торжествующе воскликнул: "Вот видите! Если химия захочет, то ... А что скажет на это ваша математика?" (то два плюс один окажутся равны двум)
30. В химии нет ... чисел (иррациональных)
40. Число атомов в молекулах должно быть ... числом. (целым положительным)
Иррациональное число содержит бесконечное число знаков в десятичной записи. Химия – наука экспериментальная, она оперирует с результатами измерений, которые выражаются или целыми числами, или дробными, но полученными с конечной точностью, как правило, не более 4 значащих цифр.
Например, показатель преломления вещества может быть равен 1.414, но не бывает равным 21/2. Поэтому числа π и e, часто возникающие в химических расчетах, обычно округляют до 3.14 и 2.72, соответственно.
50. В химии нет понятия ... (бесконечность)
Число атомов в наблюдаемой части Вселенной очень велико, но конечно, поэтому в природе нет бесконечно больших величин. Каждая физическая величина – время, энергия, масса, расстояние – имеет конечное наименьшее значение, которому присущ химический смысл.
Конкурс капитанов
Вопросы 1-му капитану:
- Латинское название золота. (аурум)
- Элемент, входящий в состав зубной пасты. (фтор)
- Жидкий металл. (ртуть)
- Соли сернистой кислоты. (сульфиты)
- Тип реакции, протекающей с образованием нового сложного и простого вещества. (замещения)
- Сколько нейтронов в ядре водорода. (ноль)
- Формула алмаза. (С)
- Какой элемент придает красный цвет крови. (железо)
- Формула плавиковой кислоты. (HF)
- Цвет индикаторной бумаги в кислой среде. (красный)
Вопросы 2-му капитану:
- Количество электронов у водорода. (один)
- Латинское название химического элемента мышьяка. (арсеникум)
- Формула воды. (H2O)
- Название щелочного металла. (натрий, калий, литий)
- Какая разница между алмазом и бриллиантом? (огранка у бриллианта)
- Цвет индикаторной бумаги в щелочи. (синий)
- Мельчайшая частица вещества. (атом)
- Название реакции между кислотой и щелочью. (нейтрализации)
- Чугун - это сплав, каких элементов. (углерода и железа)
- Соли угольной кислоты. (карбонаты)
Подведение итогов занятия
Рефлексия "Незаконченные предложения"
- Меня удивило…
- Мне было комфортно на занятии потому что…
- Я буду применять полученные знания...
- У меня не получилось…
- Меня заинтересовало…
Преподаватель химии: Дорогие ребята! Вы успешно прошли все испытания, приготовленные для Вас. Вы все достойны звания химиков и математиков.
Химия – наука, полная удивительных загадок, явлений, она всегда сопровождается красочными эффектами и "чудесами". Ребята, посмотрите, три колбы: в первой колбе содержится раствор – соляной кислоты, во второй – фенолфталеин, в третьей – хлорид бария, а в этой колбе раствор волшебного вещества.
Вы все его знаете. Оно есть почти у каждого дома. Смешаем их. Какое же это вещество? Этот вопрос будет домашним заданием.
Преподаватель математики:
Ответьте на следующие вопросы:
- Полезным ли для вас оказался этот интегрированный урок?
- Смогли ли вы выбрать наиболее подходящий для вас способ решения?
- Будете ли вы использовать эти методы в дальнейшем и при решении заданий или нет?
Домашнее задание
Задача 1
Какую массу соли надо добавить к 500 грамм 10% раствора соли, чтобы раствор стал 25%?
Задача 2
В колбе содержится 57% водный раствор соли. После выпаривания 25 грамм воды раствор стал 76 процентным. Сколько еще надо выпарить воды, чтобы содержание воды в колбе стало равным 95%. (Ответ: 15 грамм)
Задача 3
Имеются два раствора кислоты разной концентрации. Объем одного раствора 4 л, другого – 6 л. Если их слить вместе, то получится 35 % раствор кислоты. Если же слить равные объемы этих растворов, то получится 36 % раствор кислоты. Сколько литров кислоты содержится в каждом из первоначальных растворов?
Преподаватель химии: Наше занятие подошло к концу. Сейчас каждый из вас оставит на парте тот смайлик, какое настроение вы приобрели на уроке. До новых встреч!