Использование шкалы степеней окисления элементов при изучении окислительно-восстановительных процессов
Для осознанного, порой творческого подхода к работе с уравнениями окислительно-восстановительных процессов рекомендуем шкалу степеней окисления элементов.
Ее составление не вызывает у обучаемых затруднений, так как ко времени изучения этого материала изучены понятия: степень окисления, процессы окисления и восстановления, виды химической связи.
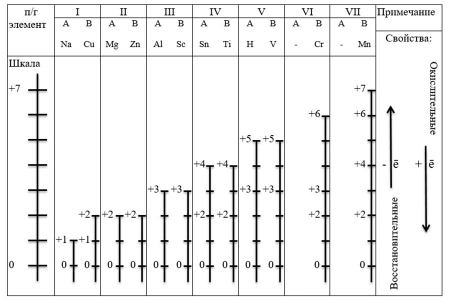
Составление шкалы степеней окисления
Металлы могут быть только восстановителями, то есть при реакции отдают электроны.
Пример: Na0-1ē=Na+; Mg0-2ē=Mg2+; Al0-3ē=Al3+
Причем, логично представить их максимальные степени окисления по группам (таблица 1).
Таблица 1. "Шкала степеней окисления металлов"
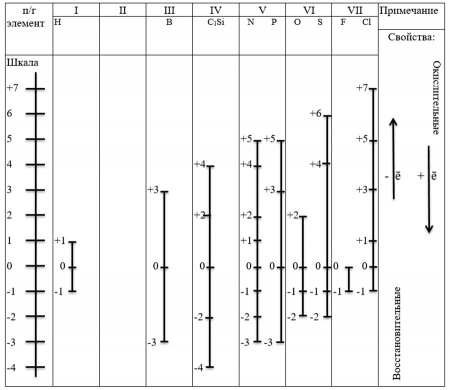
Неметаллы в реакциях могут проявлять двойственность: при реакциях с типичными восстановителями принимают от них электроны, а с более сильными окислителями – отдают. Например: С0+4ē=С-4, С0-4ē=С+4.
Поэтому их шкала включает и положительное и отрицательное степени окисления (таблица 2).
Таблица 2. "Шкала степеней окисления неметаллов"
Использование шкалы степеней окисления элементов
Пользуясь таблицами 1 и 2 попытаемся ответить на вопросы:
1. Может ли K2CrO4 быть восстановлением?
Ответ: нет, так как Cr+6 находится в максимальной степени окисления.
2. Какими свойствами (окислительными и восстановительными) обладает аммиак NH3?
Ответ: только восстановительными.
3. Могут ли протекать ОВР между веществами:
а) K + Sn →
б) K2SO3 + K2CrO4
в) K2S и HNO3
г) Na2CrO4 и KMnO4
Ответ: Невозможно протекание реакций "а" (два металла-восстановителя) и "г" (два окислителя). Реакции "б" и "в" возможны, так как в них участвуют вещества – окислители и восстановители.
4. Составить формулы возможных продуктов реакции:
а) SO2 + O2 →
б) FeCl2 + Cl2 →
в) CO2 + O2 →
г) NH3 + H2 →
Ответ: продукты реакций "а" и "б" - SO3 и FeCl3; протекание реакций "в" и "г" невозможно.
Тестовые задания
1) Какое вещество может быть только восстановлением:
а) Na2S
б) Na2SO4
в) S
г) Na2SO4 ?
Ответ: а.
2) Какое вещество может быть только окислителем:
а) Mn0
б) K2MnO4
в) MnO2
г) KMnO4 ?
Ответ: г.
Определение продуктов реакций
Реакции между простыми веществами
1. Реакции металлов с неметаллами. Например, реакция магния с хлором проходит по ОВ-"сценарию", так как магний (см. таблицу 1) – восстановитель, а хлор (в данном случае) – окислитель:
Mg0 - 2ē = Mg+2
Cl20 + 2ē = 2Cl-
Молекулярное уравнение этой реакции Mg0+Cl20 = Mg+2Cl2-
Реакции между двумя неметаллами
Вначале необходимо оценить их положение в Периодической системе, изменение их электроотрицательности. (увеличение в периоде слева – направо, в группе сверху вниз)
Если вступают в реакцию кремний и кислород, то в ней кислород будет окислителем, а кремний – восстановителем. С учетом их max и min степеней окисления (таблица 2) эти изменения выглядят так:
Что отражается в уравнении: Si + O20 = Si+4O2-2
Реакции между сложными веществами
Пример 1. Предположите возможность протекания реакции между NH3 (аммиак) и CuO (оксид меди II).
Определив степени окисления элементов N-3H3+ и Cu+2O-2, заключаем: азот N-3 – восстановитель, а Cu+2 – окислитель:
2N-3 -6ē = N20
Cu+2 + 2ē = Cu0
Схема же реакции выглядит следующим образом: NH3+CuO → Cu0 + N02 + H2O
Пример 2. Найти продукты реакции между перманганатом калия и соляной кислотой.
Анализ формул приводит к выводу: Mn+7 (в молекуле KMnO4) – окислитель, а Cl- (в HCl) – восстановитель; причем в кислой среде Mn+7 переходит в Mn+2:
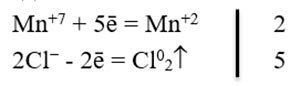
Схематично это выглядит следующим образом:
KMnO4 + HCl → Mn+2 + Cl2↑
С учетом участвующих элементов (K, H, O) схема реакции выглядит так:
KMnO4 + HCl ⇒ MnCl2 + KCl + Cl2 + H2O, а, используя электронный баланс:
Mn+7+5ē=Mn+2
2Cl- - 2ē = Cl02
Mn+7 - окислитель, процесс восстановления; Cl- - восстановитель, процесс окисления,
Cоставляем полное уравнение реакции: 2KMnO4 + 16HCl = 2MnCl2+2KCl+5Cl2+8H2O.
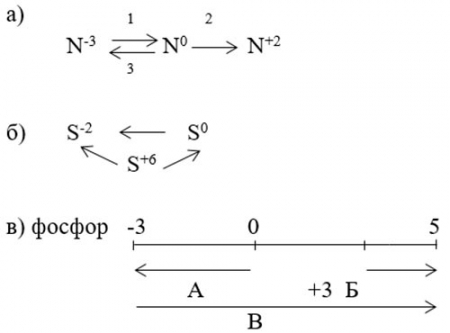
Пример 3. Почему возможна реакция между H2S и H2SO4 и невозможна между H2S и серой?
В первой паре веществ сера имеет степени окисления -2 и +6. В шкале (таблица 2) между этими степенями имеются промежуточные значения 0 и +4. Следовательно, возможны варианты реакций:
H2S + H2SO4 → S0 + H2O
H2S + H2SO4 → SO2 + H2O
Во второй паре степени окисления серы -2 и 0, между этими значениями промежуточные отсутствуют. Реакция невозможна.
Работа по схемам превращений
Предлагаем несколько вариантов схем превращений.
Разберем схему "а". Азот N-3 при превращении в N0 теряет электроны при реакции с окислителем:
1) N-3H3 + O02 → N02+H2O
В дальнейшем азот опять окисляется:
2) N02 + O2 → N+2O-2
Приобрести исходную степень окисления N0 может при реакции с восстановителями (H2, активные металлы):
3) N02 + Na0 → Na+3N-3.
Примечание: в схемах не расставлены коэффициенты, не написаны электронные уравнения с балансом, не определены ОВ-процессы. В данном случае, читатели смогут это сделать самостоятельно. Как и разобрать схемы "б" и "в".
Шкала степеней окисления проста в использовании. Обучаемые получают при этом правильные мировоззренческие представления о сути ОВ-процессах, перехода электронов, электронном балансе.
Имея шкалу, значительно легче определять вещества – окислители и восстановители, определять возможность протекания процессов, находить продукты реакций, составлять электронные уравнения и уравнения ОВ-реакций.
P.s. Посмотрите полезное видео по определению степени окисления химических элементов.